| ที่มา | มติชนสุดสัปดาห์ ฉบับวันที่ 20 - 26 มกราคม 2566 |
|---|---|
| คอลัมน์ | ทะลุกรอบ |
| ผู้เขียน | ดร. ป๋วย อุ่นใจ |
| เผยแพร่ |
“เซลล์นั้นเป็นอมตะ มีเพียงแต่ของเหลวที่พวกมันล่องลอยอยู่เท่านั้นที่เสื่อมสลาย แค่เปลี่ยนของเหลวนี้เสียใหม่จนเป็นกิจวัตร ให้สารอาหารที่พวกเซลล์ต้องการ ดังที่รับรู้ได้ กระแสแห่งชีวิตจะยังคงอยู่ไปตราบนิรันดร์”
คำกล่าวของอเล็กซิส แคร์เรล (Alexis Carrel) ศัลยแพทย์และนักวิทยาศาสตร์ผู้คว้ารางวัลโนเบลสาขาสรีรวิทยาและการแพทย์ ปี 1912 ได้สร้างกระแสความตื่นเต้นในวงการแพทย์มาเนิ่นนานเกือบครึ่งศตวรรษ
ชีวิตอมตะคือความฝัน ที่ทุกคนอยากจะฝัน
อเล็กซิสเชื่อว่าตราบใดที่สภาวะในการเพาะเลี้ยงดี มีอาหารให้อุดมสมบูรณ์ เซลล์ร่างกายของสัตว์ (รวมทั้งมนุษย์ด้วย) จะเป็นอมตะ สามารถเจริญเติบโตไปได้เรื่อยๆ ไม่มีวันสิ้นสุด
และเมื่อใดที่เราเข้าใจว่าเราจะปรับเปลี่ยนของเหลวรอบๆ เซลล์อย่างไร เซลล์จึงจะยังคงความอ่อนวัย แอ๊กทีฟ และสามารถแบ่งเซลล์ออกมาซ่อมแซมร่างกายส่วนที่สึกหรอไปได้เรื่อยๆ อย่างไม่มีข้อจำกัด เมื่อนั้น ความชราก็เป็นเพียงแค่โรคที่อาจจะรักษาได้
ขอแค่รู้ว่าจะปรับของเหลวในร่างกายอย่างไร ต้องใช้ยาอะไรที่จะกระตุ้นให้เซลล์ในร่างกายสามารถแบ่งเซลล์ออกมาซ่อมแซมส่วนต่างๆ ของร่างกายที่สึกหรอไปได้เรื่อยๆ ท้ายที่สุด จะไม่มีส่วนใดยในร่างกายที่เสื่อมสลาย
และถ้ากระตุ้นได้ดีมากๆ อาจจะถึงขนาดเปลี่ยนเซลล์ชุดใหม่ให้ทุกส่วนย้อนกลับไปอ่อนวัย “สิบแปดอีกครั้ง” ก็ยังอาจจะเป็นได้
ถ้าภารกิจนี้สำเร็จ อุปมาคงไม่ต่างการค้นพบ “น้ำพุแห่งความเยาว์วัย” เมื่อนั้น มนุษย์ก็จะกลายเป็นอมตะ หรืออย่างน้อยที่สุด ต่อให้ยังตายได้ แต่ก็อาจจะไม่แก่ และไม่เสื่อม
ที่อเล็กซิสเชื่อสุดใจว่าเซลล์นั้นเป็นอมตะ ก็เพราะว่าอัลเบิร์ต เอเบลลิง (Albert Ebeling) ที่มหาวิทยาลัยร็อกกี้เฟลเลอร์และตัวเขาเองนั้นได้ร่วมกันเพาะเลี้ยงเซลล์ไฟโบรบลาสต์จากหัวใจไก่ได้ต่อเนื่องกันยาวนานถึง 34 ปี
ซึ่งถ้าเทียบกับอายุขัยของไก่ที่เป็นเจ้าของเซลล์จริงๆ ก็คงจะตายแล้วเกิดใหม่ไปแล้วหลายตลบ
แม้ไอเดียของอเล็กซิสจะได้รับการยอมรับอย่างกว้างขวาง เลนนาร์ด เฮย์ฟลิก (Leonard Hayflick) จากสถาบันวิสตาร์ (Wistar Institute) ก็ยังแอบหวั่นไหวอยู่เป็นช่วงๆ
หลังจากทำโพสต์ดอกที่กัลเวสตัน (Galveston) เลนนาร์ดก็รับตำแหน่งหัวหน้าทีมเพาะเลี้ยงเซลล์ให้สถาบันวิสตาร์
เขาเริ่มเลี้ยงไฟโบรบลาสต์จากตัวอ่อนมนุษย์ และผลของเขาก็แปลกประหลาด หลังจากเลี้ยงไประยะหนึ่ง เซลล์ที่เขาเลี้ยงไว้จะเริ่มมีรูปร่างผิดเพี้ยนไป พวกมันแบ่งเซลล์ช้าลง และท้ายที่สุด ก็จะเลิกแบ่งและตายไป
ตอนแรก เลนนาร์ดก็นึกว่าตัวเองอาจจะเตรียมอาหารผิด หรือล้างเครื่องแก้วไม่สะอาด หรืออาจจะฝีมือยังไม่ดี
แต่ไม่ว่าจะทำซ้ำกี่ที ผลที่ได้ก็ยังเหมือนเดิม
ไม่ว่าจะเปลี่ยนอาหารดีแค่ไหน พอเลี้ยงไปสักระยะ เซลล์จะเริ่มชะงักการเจริญเติบโต เลิกแบ่งเซลล์ และจะค่อยๆ ตายหายไปเอง

เลนนาร์ดเริ่มสงสัยว่ามีอะไรผิดปกติกับแนวคิดของอเล็กซิส
เขาเริ่มหยิบสมุดแล็บของเขามาอ่านทบทวนสิ่งที่เขาทำลงไปทั้งหมด
และก็พบอะไรที่แปลกประหลาด เซลล์ที่เขาเลี้ยงไว้จะแบ่งเซลล์ได้แค่ราวๆ 40 ถึง 60 ครั้ง หลังจากนั้นพวกมันจะเริ่มหยุดการเจริญเติบโต
เลนนาร์ดมองว่านี่คือขีดจำกัดของการแบ่งเซลล์ร่างกาย
เพื่อให้เข้าใจการเติบโตของเซลล์ได้ง่ายขึ้น เลนนาร์ดเริ่มอธิบายการเลี้ยงเซลล์ของเขาเป็นเฟสๆ
โดยในช่วงแรกของการทดลอง เขาจะเรียกว่าเฟสหนึ่ง หรือการเพาะเลี้ยงแบบปฐมภูมิ (primary culture) เซลล์จะยังเริ่มปรับตัวให้เข้ากับสภาวะแวดล้อมที่เขาปรุงแต่งขึ้นมา
หลังจากปรับตัวได้แล้ว เซลล์จะเริ่มเติบโตและแบ่งเซลล์อย่างรวดเร็วในเฟสที่สองที่เลนนาร์ดเรียกว่าเป็นเฟสแห่ง “การเจริญงอกงาม (luxuriant growth)”
หลังจากเติบโตอู้ฟู่อยู่พักใหญ่ อาจจะหลักหลายเดือน เซลล์ก็จะเริ่มเสื่อมและเข้าสู่เฟสสาม หรือเฟสแห่งความชรา (senescense) พวกมันจะเริ่มชะลอการแบ่งเซลล์ให้ช้าลงเรื่อยๆ ท้ายที่สุดก็จะหยุดสนิท และค่อยๆ ล้มหายตายจากไป
เลนนาร์ดเชื่อว่าขีดจำกัดในการแบ่งเซลล์นี้จะเกิดขึ้นเมื่อเซลล์นั้นเริ่มแก่และเสื่อมถอย ความชราในระดับเซลล์นี้เชื่อมโยงกันอย่างแยกไม่ออกกับการเสื่อมของร่างกายในวัยชรา
ขีดจำกัดในการแบ่งเซลล์ร่างกายที่เลนนาร์ดค้นพบนี้ ในภายหลังถูกเรียกว่า “ขีดจำกัดเฮย์ฟลิก (Hayflick limit)” ตามนามสกุลของเขา
ชัดเจนว่าเซลล์ร่างกายที่จริงแล้วนั้นไม่ได้มีศักยภาพที่จะแบ่งเซลล์ได้มากมายไม่จำกัดอย่างที่อเล็กซิสบอก
นักวิทยาศาสตร์รางวัลโนเบลก็ผิดได้
หลังจากที่เลนนาร์ดเจอขีดจำกัดของเฮย์ฟลิก น้ำพุแห่งความเยาว์วัยก็กลายเป็นแค่ ความฝันลมๆ แล้งๆ ที่พังทลายไม่เป็นท่า
แต่ก็ใช่ว่าทุกคนจะยอมแพ้ ในเวลานี้ก็ยังมีคนให้ความสนใจมากมายในศาสตร์แห่งการชะลอและย้อนวัย
ในเวลานั้น ขีดจำกัดเฮย์ฟลิก กลายเป็น “เส้นแบ่งของวัยเยาว์และความเสื่อมถอย” ที่นักวิจัยมากมายให้ความสนใจ
แต่ก็ยังคงมีคำถามมากมายที่ยังไม่มีคำตอบ เช่น มีอะไรกันแน่เกิดขึ้นภายในเซลล์?
จู่ๆ ทำไมเซลล์จึงได้หยุดแบ่งเอาเสียดื้อๆ?
สวิตช์แห่งความชรานั้นอยู่ที่ไหนกันแน่?
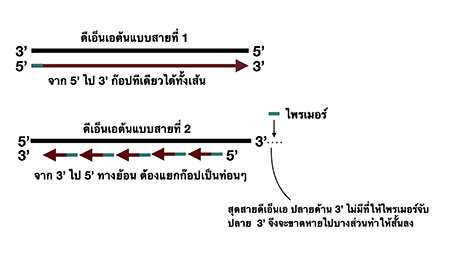
จนกระทั่งในช่วงต้นทศวรรษที่ 1970s เจมส์ วัตสัน (James Watson) หนึ่งในผู้ค้นพบโครงสร้างเกลียวคู่ของดีเอ็นเอ ได้ตีพิมพ์เผยแพร่แนวคิดปัญหาการคัดลอกปลายสารพันธุกรรม (End-replication problem) ในวารสาร Nature New Biology
วัตสันมองว่าด้วยกลไกการจำลองรหัสดีเอ็นเอ ที่จะเกิดขึ้นแบบมีทิศทางแน่นอน จากปลาย 5′ ไป 3′
ปลายข้างหนึ่งของดีเอ็นเอที่เรียกว่าปลาย 3′ จะขาดหายและไม่ถูกก๊อปปี้ไปด้วยในระหว่างการจำลองแบบดีเอ็นเอ ปลายข้างนี้จะค่อยๆ หดสั้นลงเรื่อยๆ ในการจำลองแบบสารพันธุกรรม
เปเปอร์ของวัตสันได้จุดประกายไอเดียให้กับอเล็กซีย์ โอลอฟนิคอฟ (Alexey Olovnikov) นักชีววิทยาทฤษฎีชาวรัสเซียอย่างแรง หลังจากอ่านเปเปอร์วัตสัน และได้ฟังบรรยายเกี่ยวกับขีดจำกัดเฮย์ฟลิก
อเล็กซีย์ก็ครุ่นคิดว่าเกิดอะไรขึ้นในเซลล์กันแน่ มีกลไกอะไรที่ทำให้เซลล์ชะงักการแบ่งเซลล์เพิ่มจำนวน
และในขณะที่เขากำลังรอรถไฟอยู่ในสถานีรถไฟใต้ดินในกรุงมอสโก ชั่ววินาทีที่รถไฟกำลังเข้าจอด ไอเดียก็แว้บเข้ามาในสมอง
ถ้ามองรถไฟเป็นเหมือนเอนไซม์ดีเอ็นเอโพลิเมอเรสที่ใช้ในการก๊อบปี้ดีเอ็นเอ และรางเป็นสายดีเอ็นเอ แล้วถ้าเอนไซม์เริ่มก๊อบปี้ดีเอ็นเอข้างใต้ ดีเอ็นเอท่อนแรกจะหายไปเสมอ เพราะมันจะอยู่ใต้เครื่องยนต์ก่อนถึงจุดที่เอนไซม์จะเริ่มก๊อบได้
นั่นหมายความว่าในทุกครั้งของการแบ่งเซลล์สายดีเอ็นเอ ดีเอ็นเอจะสั้นลงทีละท่อน และมันควรจะสั้นลงเรื่อยๆ ในทุกครั้งของการแบ่งเซลล์
และนั่นอาจจะเป็นสาเหตุที่ทำให้เซลล์หยุดแบ่ง
ไอเดียนี้ล่องลอยอยู่ในวงการอย่างยาวนาน จนกระทั่งในปี 1978 ที่เมืองเบิร์กลีย์ แคลิฟอร์เนีย อลิซาเบธ แบล็กเบิร์น (Elizabeth Blackburn) และโจเซฟ แกล (Joseph Gall) ที่เลือกศึกษาปลายสายดีเอ็นเอของโปรโตซัว Tetrahymena thermophila
ก็ได้ค้นพบว่าที่จริงแล้วที่ปลายสายดีเอ็นเอ หรือที่เรียกกันว่าเทโลเมียร์ (telomere) ของ Tetrahymena นั้นเป็นรหัสพันธุกรรมง่ายๆ TTGGGG เรียงซ้ำไปซ้ำมายืดยาวเป็นพันซ้ำ
ในขณะที่เทโลเมียร์ของมนุษย์นั้นก็ไม่ต่างกันมาก แค่เปลี่ยนเป็นรหัส TTAGGG ซ้ำไปซ้ำมาเช่นกัน ในเวลานั้น อลิซาเบธเริ่มสนใจเทโลเมียร์อย่างจริงจัง และได้สร้างทีมวิจัยข้ามศาสตร์เพื่อศึกษาปลายโครโมโซมกันอย่างเป็นล่ำเป็นสัน
หลายคนในทีมวิจัยของเธอ ได้กลายเป็นดรีมทีมของวงการชะลอวัยในเวลาต่อมา
แครอล เกรเดอร์ (Carol Greider) นักศึกษาปริญญาเอกของเธอค้นพบเอนไซม์เทโลเมีย เทอร์มินัล ทรานสเฟอเรส (telomere terminal transferase) ที่ใช้ในการต่อปลายเทโลเมียร์ให้ยืดยาวออกเพื่อรีเซ็ตอายุขัยของเซลล์ในช่วงก่อนการแบ่งเซลล์ (ภายหลังเอนไซม์นี้ รู้จักกันในนามเอนไซม์เทโลเมียเรส (telomerase)) ในปี 1985
และแครอลนี่เองที่เป็นคนพบคนแรกว่าในทุกครั้งที่เซลล์ไฟโบรบลาสต์แบ่งจากหนึ่งเป็นสอง บริเวณปลายโครโมโซมที่เรียกว่าเทโลเมียร์ นั้นจะหดสั้นลงเรื่อยๆ และเซลล์จะหยุดแบ่งเซลล์เมื่อปลายโครโมโซมสั้นจนถึงจุดวิกฤต ในช่วงต้นทศวรรษที่ 1990s
งานวิจัยของแครอล ช่วยไขปริศนาแห่งขีดจำกัดเฮย์ฟลิก และอธิบายหนึ่งในกลไกที่สำคัญที่สุดของการชรา…
ย้อนกลับมาในปี 2023 ภารกิจสุดขอบฟ้าตามหาน้ำพุแห่งความเยาว์วัยกลับมาอีกครั้ง
กลไกแห่งความชราในระดับเซลล์นั้น กำลังกลับมาเป็นทอล์กออฟเดอะทาวน์
แต่คราวนี้ไม่ใช่แค่เพื่อศึกษาดูปลายโครโมโซม…นั่นมันสำหรับปี 70 ไม่ใช่ปัจจุบัน
อัพเดตล่าสุด จากโครงการเมกะโปรเจ็กต์สำรวจสำมะโนประชากรของเซลล์ในร่างกายของมนุษย์ และอีกสารพัดงานวิจัย เจอเซอร์ไพรส์ครั้งใหญ่
นั่นก็คือ ในอวัยวะต่างๆ ของเรามีเซลล์เข้าข่าย senescence หรือเซลล์ชราอยู่ด้วย
และที่น่าตกใจที่สุดคือสัดส่วนที่เจอนั้นเยอะกว่าที่คิดมาก ในบางอวัยวะอาจพบมากถึงหนึ่งในสาม
เซลล์ชราเหล่านี้มีผลกระทบต่อร่างกายมากกว่าที่คิด อาจส่งผลต่อช่วงชีวิต (life span) และช่วงชีวิตที่มีสุขภาพแข็งแรงสมบูรณ์ (health span) ได้อย่างมากมายมหาศาล ในบางกรณี เซลล์ชราอาจมีส่วนทำให้เกิดโรคเรื้อรัง โรคเสื่อมบางโรคด้วย
และนั่นทำให้สถาบันสาธารณสุขแห่งชาติ สหรัฐอเมริกา ยอมลงทุนมหาศาล ต่อยอดจากการสำรวจสำมะโนประชากรเซลล์ทั้งร่างของมนุษย์ เพื่อทำแผนที่ระบุตำแหน่งเซลล์ชรา
“เพื่อกำหนดเป้าสังหาร!”
สะดวก ฉับไว คุ้มค่า สมัครสมาชิกนิตยสารมติชนสุดสัปดาห์ได้ที่นี่https://t.co/KYFMEpsHWj
— MatichonWeekly มติชนสุดสัปดาห์ (@matichonweekly) July 27, 2022








