| ที่มา | มติชนสุดสัปดาห์ ฉบับวันที่ 22 - 28 กันยายน 2566 |
|---|---|
| คอลัมน์ | Biology Beyond Nature |
| ผู้เขียน | ภาคภูมิ ทรัพย์สุนทร |
| เผยแพร่ |
ยีนมนุษย์แสดงออกในแบคทีเรียได้หรือไม่?
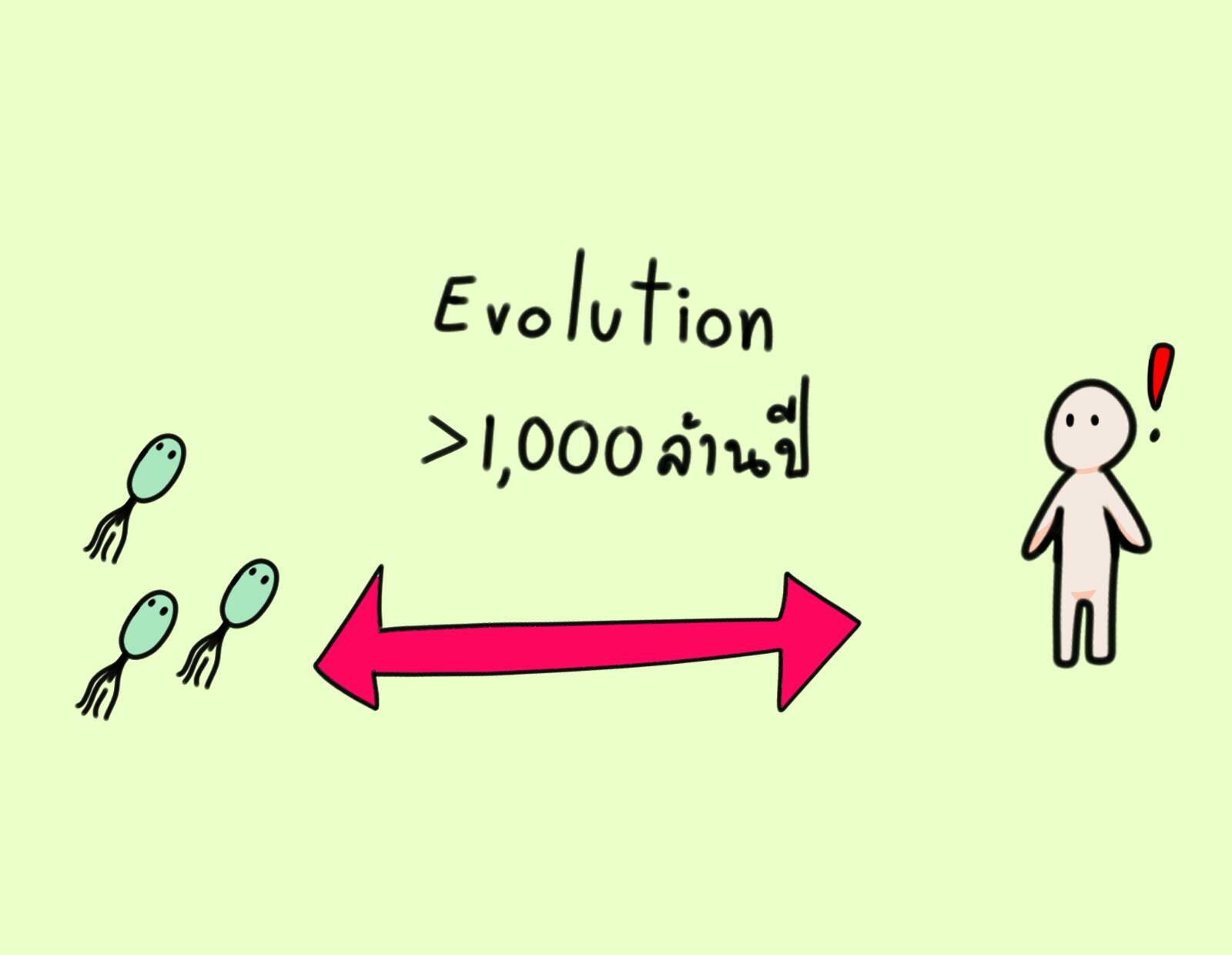
นักชีวโมเลกุลส่วนมากในช่วงยุค 1970 คงจะตอบว่า “ไม่น่าได้”
มนุษย์กับแบคทีเรียวิวัฒนาการห่างกันหลายพันล้านปี กลไกต่างๆ ในเซลล์รวมทั้งการแสดงออกข้อมูลพันธุกรรมในยีนเพื่อผลิตเป็นโปรตีนน่าจะต่างกันโดยสิ้นเชิงจนไม่น่าทำงานร่วมกันได้
เปรียบเหมือนการเอาแอพพลิเคชั่นจากไอโฟนรุ่นล่าสุดไปรันบนเครื่องคอมพิวเตอร์วินโดวส์ 95
แต่ Robert Swanson นักลงทุนหนุ่มถังแตกวัย 29 ในเวลานั้นเชื่อว่า “เป็นไปได้”
เขาเดิมพันด้วยเงินลงทุนก้อนสุดท้าย และเครดิตในหน้าที่การงานที่หลงเหลืออยู่ ยอมล่มหัวจมท้ายกับ Herbert Boyer นักวิจัยสุดเซอร์จาก UCSF ผู้โด่งดังจากการคิดค้นเทคนิคการตัดต่อดีเอ็นเอไม่กี่ปีก่อนหน้านี้
สตาร์ตอัพภายใต้ชื่อ “Genentech” ของทั้งคู่ระดมเงินลงทุนได้ $ 100,000 จาก Kleiner & Perkins บริษัทร่วมลงทุน (Venture Capital, VC) ชื่อชั้นนำทั้งๆ ที่มีแค่ไอเดียบนกระดาษหกแผ่น ไม่มีสิทธิบัตร ห้องแล็บ ผลิตภัณฑ์ หรือต้นแบบอะไรทั้งนั้น
นี่อาจจะเป็นโอกาสเดียวที่ Swanson จะได้ร่ำรวยและจารึกชื่อในประวัติศาสตร์วงการไบโอเทคและอุตสาหกรรมการแพทย์
Genentech ขายฝันกับนักลงทุนว่าจะตัดต่อยีนอินซูลิน (insulin) จากมนุษย์ใส่แบคทีเรีย Escherichia coli (E.coli) ให้ผลิตโปรตีนอินซูลินบริสุทธิ์มูลค่ามหาศาล
แต่ก่อนอื่นต้องพิสูจน์ว่ายีนมนุษย์สามารถแสดงออกได้ในแบคทีเรียก่อน
นอกจากความท้าทายในการแสดงออกยีนข้ามสปีชีส์สิ่งมีชีวิตแล้ว แค่การตัดต่อดีเอ็นเอยังเป็นเรื่องยากลำบาก
ขณะที่นักวิจัยยุคปัจจุบันสามารถสั่งซื้อดีเอ็นเอ เอนไซม์ และวัตถุดิบทำวิจัยอื่นๆ ได้เพียงชั่วข้ามคืนจากบริษัทผู้ค้าที่มีให้เลือกมากมาย
นักวิจัยในยุค 1970s ต้องผลิตสิ่งเหล่านี้แทบทั้งหมดในห้องแล็บ หรือไม่ก็ต้องไปกราบกรานขอเจียดมาจากแล็บอื่นๆ ที่ชำนาญกว่า
Boyer ในฐานะเจ้าพ่อวงการพันธุวิศวกรรมอาจจะได้เปรียบเรื่องการผลิตเอนไซม์สำหรับตัดต่อดีเอ็นเอ และสร้างพลาสมิด (ชิ้นดีเอ็นเอพาหะสำหรับนำยีนเข้าไปเพิ่มจำนวนในแบคทีเรีย)
แต่ปัญหาคือจะไปเอาดีเอ็นเอที่มียีนอินซูลินของมนุษย์จากไหน?
ถ้าจะสกัดจากเซลล์มนุษย์แล้วเราจะแยกเฉพาะส่วนที่เป็นยีนอินซูลิน (ขนาดพันกว่าคู่เบสจากดีเอ็นเอทั้งหมดหกพันล้านคู่เบส) ออกมาอย่างไร?
อย่าลืมว่าเทคนิคการก๊อบปี้ดีเอ็นเอเฉพาะส่วน (PCR) ยังไม่ถูกคิดค้นขึ้นในช่วงเวลานั้น
อีกทางเลือกคือการสังเคราะห์ดีเอ็นเอที่เราสนใจขึ้นมาใหม่เลยด้วยกระบวนการทางเคมี
อยากได้ยีนอินซูลินของมนุษย์ก็สังเคราะห์ดีเอ็นเอที่มีลำดับเบสแบบในมนุษย์ขึ้นมาในหลอดทดลอง
ถ้าเป็นยุคปัจจุบันก็มีบริษัทมากมายรับจ้างสังเคราะห์ให้ได้ในไม่กี่วัน แต่ในยุค 1970s นี่คือเทคนิคหายากที่มีจำนวนผู้ชำนาญการแทบจะนับคนได้
Cr. ณฤภรณ์ โสดา
ทีมวิจัยของ Arthur Riggs และ Keiichi Itakura แห่งศูนย์วิจัยการแพทย์ City of Hope จากแคลิฟอร์เนียตอนใต้เป็นหนึ่งในผู้ชำนาญเทคนิคหายากนี้ แต่ดีเอ็นเอสังเคราะห์ที่ได้มีปริมาณน้อยและความบริสุทธิ์ต่ำเกินกว่าจะเอาไปใช้อะไรจริงจังได้
พอทีมวิจัยได้ไปฟังเรื่องราว Boyer ในงานสัมมนาช่วงปี 1975 ก็ได้ไอเดียว่าถ้าเราเอาดีเอ็นเอสังเคราะห์นี้ตัดต่อเข้าไปใส่พลาสมิดด้วยเทคนิคของ Boyer จากนั้นก็เอาไปฝากไว้กับแบคทีเรีย E.coli พอแบคทีเรียแบ่งตัวดีเอ็นเอเราก็แบ่งตามไปด้วย ด้วยวิธีนี้เราต้องสังเคราะห์และทำบริสุทธิ์ดีเอ็นเอแค่ครั้งเดียวเท่านั้น ไม่ต้องเยอะ จากนั้นให้เป็นหน้าที่ของแบคทีเรียใน “การโคลนนิ่ง (cloning)” เพิ่มจำนวนชิ้นดีเอ็นเอมากเท่าไหร่ก็ได้ตามที่เราต้องการ
ทีมวิจัยของ Riggs และ Itakura ร่วมงานกับ Boyer ในการทดลองโคลนนิ่ง lac operator ชิ้นดีเอ็นเอสายสั้นๆ ขนาดแค่ 21 เบสที่ทำหน้าที่เป็นสวิตช์เปิดปิดยีนใน E.coli
ทีมวิจัยพิสูจน์ว่าชิ้นดีเอ็นเอสังเคราะห์ทำงานได้จริงในเซลล์ E.coli ไม่ต่างจาก lac operator ตามธรรมชาติ งานนี้เป็นข้อพิสูจน์สำคัญว่าดีเอ็นเอสังเคราะห์ที่มนุษย์เราสร้างขึ้นด้วยวิธีทางเคมีสามารถหลอมรวมเป็นส่วนหนึ่งของระบบการแสดงออกยีนในเซลล์เป็นๆ ได้
ถือเป็นการเปิดประตูเชื่อมต่อระหว่างโลกของเคมีสังเคราะห์กับพันธุวิศวกรรม งานวิจัยนี้ตีพิมพ์ในวารสารวิชาการชั้นนำอย่าง Nature ในเดือนตุลาคม 1976 เพียงไม่กี่เดือนหลังจาก Boyer ก่อตั้ง Genentech
Cr. ณฤภรณ์ โสดา
ระหว่างที่ทำโครงการนี้ทีมของ Riggs และ Itakura ก็คิดการใหญ่กว่านั้น ถ้าดีเอ็นเอสังเคราะห์ในพลาสมิดทำงานในแบคทีเรียได้เหมือนดีเอ็นเอธรรมชาติ เราก็น่าจะสามารถสังเคราะห์ดีเอ็นเอของยีนผลิตฮอร์โมนอะไรก็ได้ที่เราสนใจ จากนั้นก็เอาไปให้แบคทีเรียผลิตฮอร์โมนมาให้เราใช้
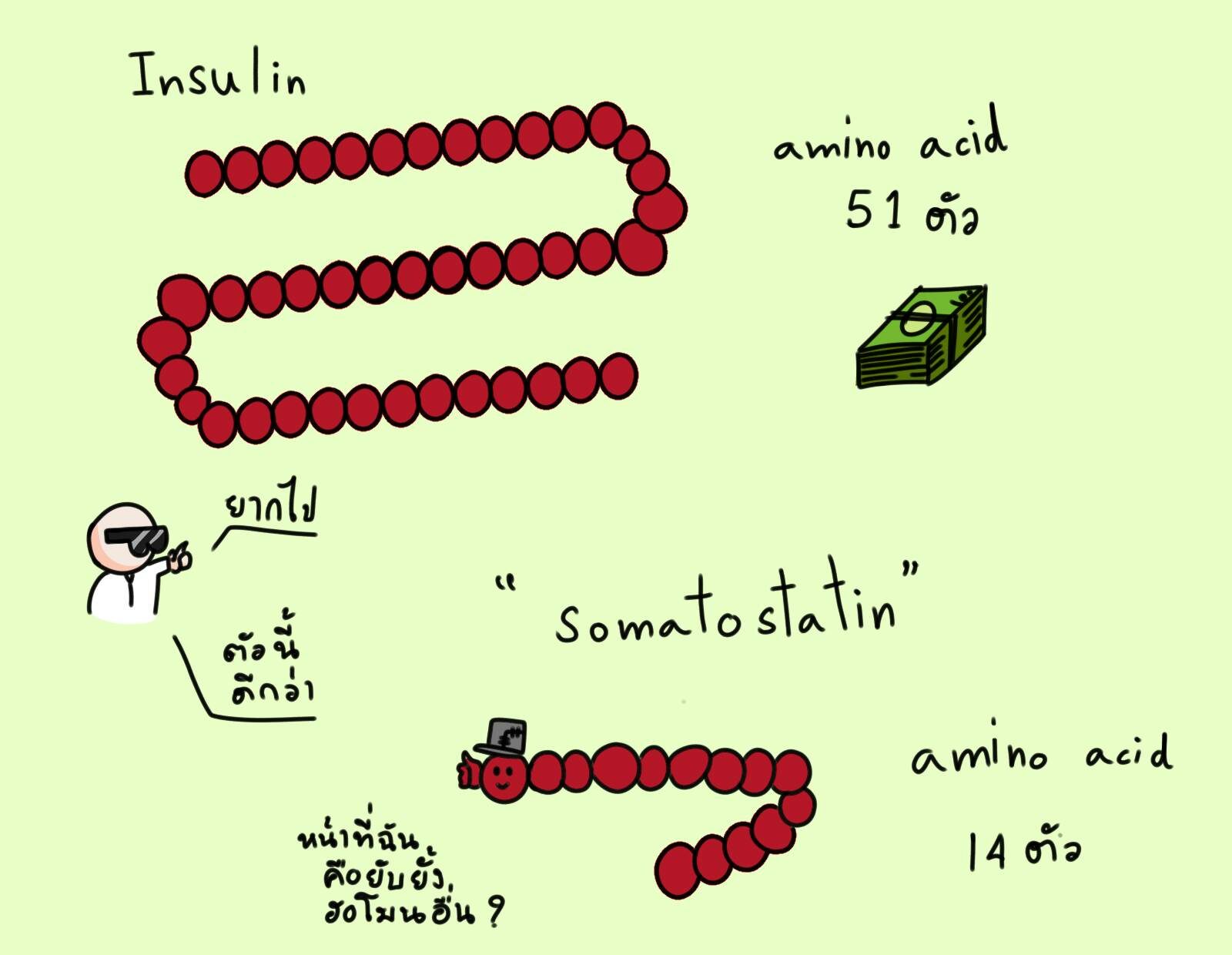
ไอเดียนี้ไปคล้ายกับของ Swanson และ Boyer โดยไม่ได้นัดหมาย แต่ Riggs และ Itakura คิดว่าน่าจะเริ่มจากฮอร์โมนโมเลกุลเล็กๆ ที่สังเคราะห์ง่ายๆ ก่อน
อินซูลินมีมูลค่าตลาดมหาศาลก็จริง แต่โปรตีนฮอร์โมนชนิดนี้ประกอบด้วยโปรตีนสองสายขนาดความยาว 51 กรดอะมิโน Riggs และ Itakura มองว่ายากเกินไป และเลือกโฟกัสที่โปรตีนฮอร์โมน “โซมาโทสแททิน (somatostatin)” ที่มีหน้าที่ยับยั้งฮอร์โมนอื่นๆ อีกหลายตัวในร่างกาย ฮอร์โมนนี้เป็นโปรตีนสายเดี่ยวยาวแค่ 14 กรดอะมิโนเท่านั้น แต่ฮอร์โมนตัวนี้ไม่ได้มีตลาดชัดเจน ทำออกมาก็คงขายไม่ได้
Riggs และ Itakura เขียนโครงการขอทุนวิจัยจากสถาบันสุขภาพสหรัฐ (NIH) ตั้งเป้าทดลองผลิต “โซมาโทสแททิน” ในแบคทีเรียด้วยยีนจากดีเอ็นเอสังเคราะห์ภายในสามปี
ระหว่างที่รอพิจารณาทุนวิจัย Boyer ที่เพิ่งก่อตั้ง Genentech ได้หมาดๆ ก็ติดต่อกลับมาชวนร่วมงานกันอีกในโครงการผลิต “อินซูลิน”
Riggs และ Itakura เสนอทาง Genentech ให้มาลองทำ “โซมาโทสแททิน” ให้สำเร็จก่อนจะข้ามไปทำงานที่ยากกว่าอย่าง “อินซูลิน”
นักวิจัยอย่าง Boyer เห็นด้วยกับข้อเสนอนี้ขณะที่นักลงทุนอย่าง Swanson คัดค้านสุดตัว
ในมุมของ Swanson ถ้าเป้าหมายสุดท้ายคือ “อินซูลิน” บริษัทก็ควรมุ่งตรงไปทางนั้น จะมามัวทำการทดลองผลิตโปรตีนที่ขายไม่ได้ทำไมไร้สาระ
ในช่วงเวลาใกล้เคียงกันผู้ทรงคุณวุฒิจาก NIH ก็ปฏิเสธการให้ทุนวิจัยโครงการของ Riggs และ Itakura ด้วยเหตุผลว่าทีมวิจัยไม่น่าทำงานนี้ได้สำเร็จในสามปี
และต่อให้สำเร็จก็ได้แค่งานวิจัยขึ้นหิ้งที่เอาไปใช้ประโยชน์ไม่ได้จริง
หลังเจรจาต่อรองกันนาน Swanson ก็ฝืนยอมตกลงให้ทีมวิจัยลองทำ “โซมาโทสแททิน” กันก่อนภายใต้งบฯ วิจัยของ Genentech นอกจากนี้ยังได้ไปเชิญ Richard Scheller ศิษย์ก้นกุฏิของ Itakura ที่ตอนนี้เรียนปริญญาเอกอยู่ที่สถาบันเทคโนโลยีแคลิฟอร์เนีย (Caltech) มาเป็นลูกมือช่วยในงานสังเคราะห์ดีเอ็นเอ Scheller ในวัย 22 ได้เงินเดือนกับหุ้นอีก 1,500 หุ้น จาก Genentech มาแบบงงๆ
“ตอนนั้นผมไว้เปียยาวถึงครึ่งหลัง พี้กัญชาทุกวัน ไม่สนเชี่ยไรทั้งนั้นเรื่องเงินหรือหุ้น ทำแต่งานวิจัย โชคดีที่ยังเก็บหุ้นไว้” Scheller เคยให้สัมภาษณ์เมื่อยี่สิบกว่าปีให้หลังขณะที่ดำรงตำแหน่งรองประธาน Genentech
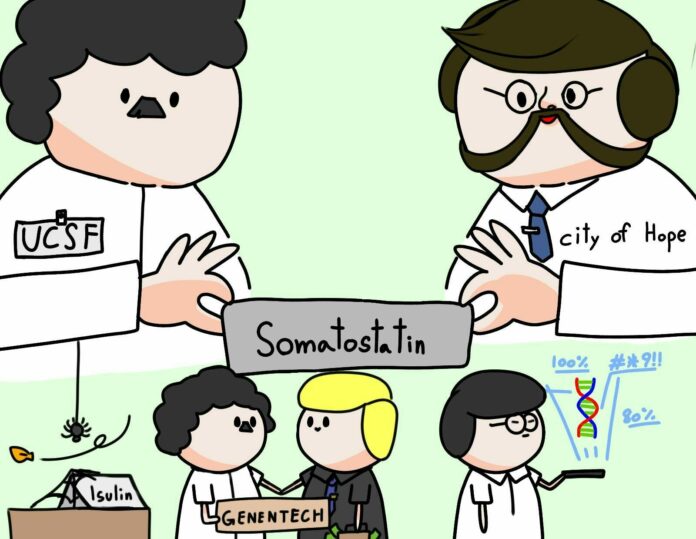
ต้นปี 1977 Genentech ระดมทุนได้อีก $ 850,000 สำหรับงานผลิตโซมาโทสแททิน และมีสัญญาร่วมมือกับนักวิจัยจากสามสถาบันชั้นนำ ได้แก่ UCSF, City of Hope และ Caltech
ทีมวิจัยจาก City of Hope และ Caltech ทำงานหามรุ่งหามค่ำอยู่หลายเดือนเพื่อสังเคราะห์ดีเอ็นเอสายสั้นๆ แปดชิ้นมาประกอบกันเป็นยีนผลิตโซมาโทสแททิน
แต่ทำเท่าไหร่ก็ไม่ได้ลำดับเบสที่ถูกต้องและบริสุทธิ์เพียงพอ
Scheller จาก Caltech ลาออกจากโครงการวิจัยไป
ขณะที่ทีม City of Hope ได้ลูกมือเป็นนักวิจัยหน้าใหม่อีกสองคนชาวญี่ปุ่นกับชาวอิตาเลียน
ระหว่างนั้น Swanson ก็เทียวบินลงไป City of Hope คอยไล่จี้ทีมวิจัยแทบจะหายใจรดต้นคอว่าเมื่อไหร่งานจะเสร็จ Riggs และ Itakura ให้สัมภาษณ์ภายหลังว่านี่เป็นช่วงเวลาการทำงานที่อึดอัดน่ารำคาญที่สุด
ธรรมชาติของงานวิจัยที่ต้องค่อยๆ คิด ใช้เวลาตกผลึก และยอมรับความเสี่ยงที่ผลจะไม่ได้ดั่งใจ ขัดแย้งกับแนวคิดแบบนักธุรกิจนักลงทุนที่อยากได้ตารางเวลาเป๊ะๆและผลลัพธ์ที่การันตีได้
ด้วยเทคนิคการสังเคราะห์และทำบริสุทธิ์ดีเอ็นเอแบบใหม่ ทีมวิจัยสังเคราะห์ยีนผลิตโซมาโทสแททินสำเร็จในเดือนพฤษภาคมปี 1977 ชิ้นดีเอ็นเอถูกส่งต่อให้ทีม UCSF ของ Boyer ดำเนินการโดยลูกมือนักวิจัยอีกสองคนชาวดัชต์กับชาวเม็กซิกัน ชิ้นยีนถูกประกอบเข้าสู่พลาสมิดก่อนจะนำใส่กลับเข้าไปแสดงออกในแบคทีเรีย E.coli
Riggs เชิญทีมจาก UCSF และ Genetech ลงมา City of Hope มาร่วมเป็นประจักษ์พยานความสำเร็จ และวันชี้ชะตาก็มาถึง ทีมนักวิจัยและนักลงทุนล้อมวงกันจ้องมองผลการทดสอบโซมาโทสแททินบนโคโลนีแบคทีเรีย
แต่ผลการทดสอบคือความว่างเปล่า
ทีมวิจัยส่ายหัวด้วยความผิดหวัง ขณะที่นักลงทุนอย่าง Swanson ตกใจแทบช็อก
เช้าวันรุ่งขึ้น Swanson ที่หน้าซีดขาวราวกับศพถ่อสังขารไปห้องฉุกเฉินโรงพยาบาล และถูกวินิจฉัยว่าป่วยด้วยอาการอาหารไม่ย่อยเฉียบพลัน อาจจะมาจากความเครียดขั้นสุดเมื่อคิดถึงอนาคตที่มืดมนลงของ Genentech
ส่วนทีมวิจัยฟื้นตัวเร็วกว่านั้น ความล้มเหลวในการทดลองเป็นเรื่องปกติของงานวิทยาศาสตร์ แค่ตั้งสติดีๆ แล้วหาทางแก้ปัญหา
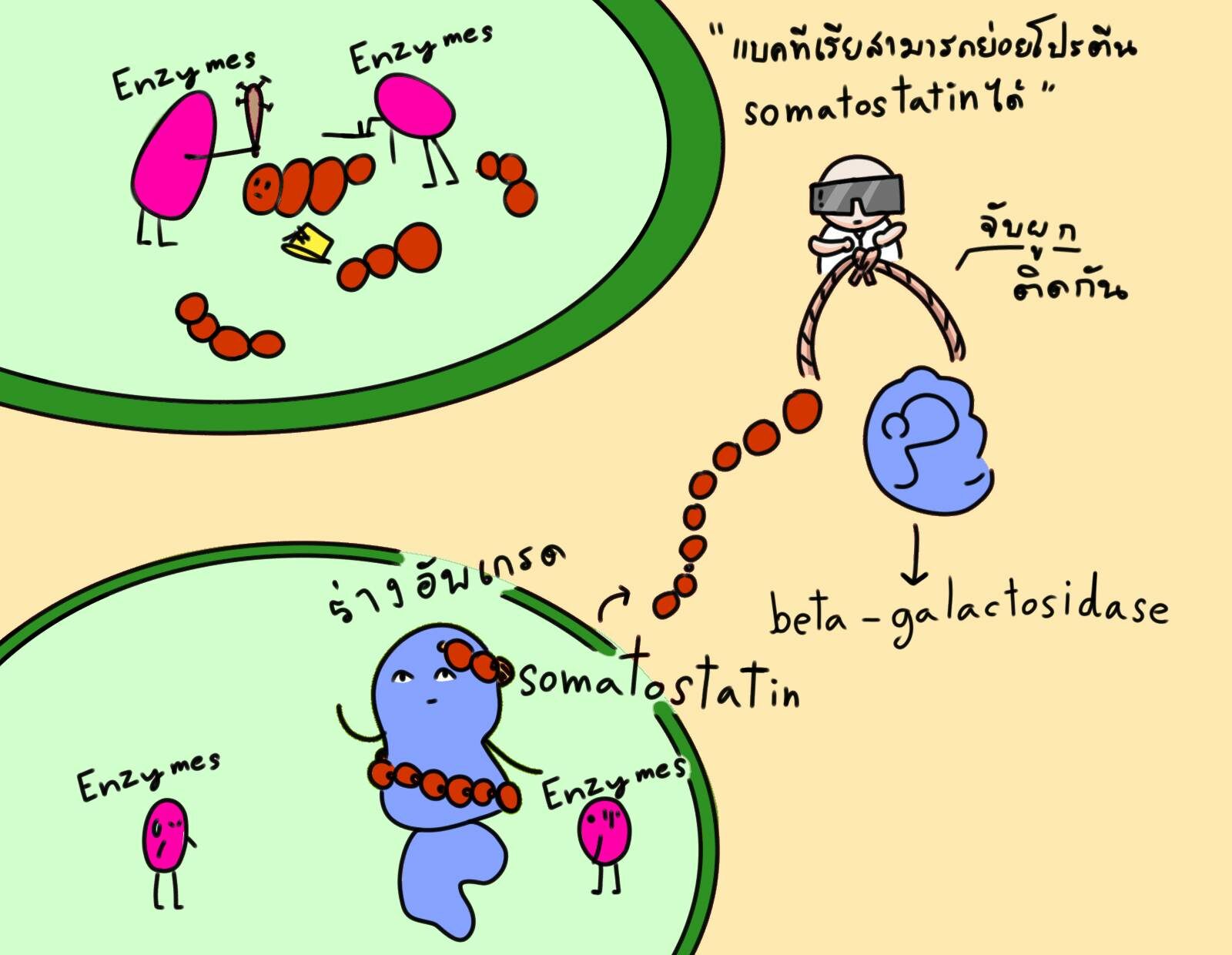
ทีมวิจัยคิดว่าปัญหาคือแบคทีเรียมีเอนไซม์ที่ย่อยสลายโปรตีนตัวนี้ ทางแก้ที่คิดออกคือวิศวกรรมใหม่เอาชิ้นยีนผลิตโปรตีนโซมาโทสแททิน (ที่ขนาดเล็กมาก) ไปเชื่อมต่อกับยีนผลิตโปรตีนแบคทีเรีย (ยีน beta-galactosidase) ที่ใหญ่กว่า ใหญ่พอที่เอนไซม์แบคทีเรียจะย่อยสลายมันไม่ทัน
จากนั้นก็สกัดโปรตีนพ่วงทั้งชิ้นนี้ออกมา ก่อนจะตัดเอาเฉพาะส่วนโซมาโทสแททินออกมาใช้งาน
เดือนสิงหาคม 1977 ทีม City of Hope ดำเนินการทดลองซ้ำรอบนี้ได้ผลออกมาชัดเจนสวยงาม ทดสอบยืนยันว่าเป็นโซมาโทสแททินของมนุษย์จริงๆ
ความสำเร็จครั้งนี้ทำลายข้อกังขาว่ายีนของมนุษย์จะสามารถทำงานในแบคทีเรียที่ห่างจากเราหลายพันล้านปีตามวิวัฒนาการได้หรือไม่ และเปิดประตูความเป็นไปได้ในการสังเคราะห์โปรตีนมูลค่าสูงอื่นๆ รวมทั้งอินซูลินด้วยเทคโนโลยีพันธุวิศวกรรม
ข่าวความสำเร็จนี้ถูกนำเข้าสู่คณะกรรมการของสภาคองเกรสที่กำลังพิจารณาเรื่องกฎหมายข้อบังคับว่าด้วยการทำพันธุวิศวกรรม เหล่าผู้สนับสนุนหวังว่าข่าวนี้จะช่วยให้คณะกรรมการชั่งน้ำหนักถึงประโยชน์มหาศาลของเทคโนโลยีนี้ อาจจะคุ้มค่ากับความเสี่ยงด้านความปลอดภัยชีวภาพ และต้นทุนค่าเสียโอกาสหากสหรัฐพลาดโอกาสเก็บเกี่ยวผลประโยชน์จากมัน
จากคณะกรรมการสภาเรื่องราวของการผลิตโซมาโทสแททินเผยแพร่ต่อเป็นข่าวใหญ่ไปสู่หนังสือพิมพ์และสื่อกระแสหลักขณะนั้น ปลายปี 1977 บริษัทยาและไบโอเทคอย่างน้อยสิบห้าแห่งเตรียมกระโดดลงมาเล่นเรื่องเทคโนโลยีนี้เต็มตัว ผิดจากเมื่อไม่กี่ปีก่อนที่ยังรีๆ รอๆ กันอยู่
แต่เรื่องวุ่นวายและประเด็นดราม่าของ Genentech เพิ่งเริ่มต้นขึ้น
การเผยแพร่งานวิจัยเป็นข่าวใหญ่โตก่อนการตีพิมพ์ในวารสารวิชาการที่ผ่านการประเมินจากผู้เชี่ยวชาญภายนอก (peer-review) ถือว่าผิดธรรมเนียมปฏิบัติสมัยนี้ แม้ว่าเรื่องนี้ยังคงเป็นประเด็นถกเถียงมาถึงปัจจุบัน แต่หลายทีมวิจัยจากหลายสถาบันก็เริ่มหันมาทำแบบนี้มากขึ้นไม่ว่าจะเพราะอยากชิงพื้นที่ข่าวหรืออยากจะช่วยร่นระยะเวลาที่คนอื่นๆ จะได้ใช้ประโยชน์จากผลงานแทนที่จะต้องรอกระบวนการ peer-review ที่ยาวนาน
ประเด็นต่อมาว่าด้วยผลประโยชน์ทับซ้อนของอาจารย์มหาวิทยาลัยที่ทำงานร่วมกับภาคเอกชน แม้ก่อนหน้านี้จะมีเคสที่บริษัทเอกชนมาให้ทุนทำวิจัยร่วมกับมหาวิทยาลัยหลายเคส
แต่เคสของ Boyer ไปไกลกว่านั้นมาก เขาเป็นทั้งผู้ร่วมก่อตั้ง, รองประธาน, บอร์ด, ที่ปรึกษา และผู้ถือหุ้นใหญ่ของ Genentech ทั้งที่ยังดำรงตำแหน่งเป็นอาจารย์เต็มเวลาที่ UCSF ใช้ประโยชน์จากเครื่องไม้เครื่องมือ นักศึกษา และสิทธิพิเศษต่างๆ ของอาจารย์
ด้วยเหตุนี้ Boyer จึงถูกวิพากษ์วิจารณ์อย่างหนักโดยเฉพาะจากเหล่าอาจารย์ด้วยกันในภาควิชา
เรื่องนี้ Boyer ออกมาตอบโต้ว่าเขาจำเป็นต้องลงมาลุยงานบริษัทเองเพื่อให้งานวิจัยได้ออกสู่มือสาธารณชนเร็วๆ
ประเด็นสุดท้ายว่าด้วยการแบ่งปันผลประโยชน์ของทีมวิจัย ระหว่างทีม City of Hope กับ UCSF ใครควรจะได้ชื่อแรกในเปเปอร์งานวิจัยชิ้นสำคัญ?
ใครควรจะได้เครดิตเป็นผู้ประดิษฐ์ (inventor) ของสิทธิบัตรมูลค่ามหาศาลนี้?
เพราะต่างฝ่ายก็ต่างเริ่มอ้างว่าตัวเองทำงานมากกว่า
สุดท้ายที่ปรึกษาด้านกฎหมายทรัพย์สินทางปัญญาของ Genentech ลงมาไกล่เกลี่ยตัดสินให้ทีม City of Hope ได้ชื่อแรกในเปเปอร์ไป แถมยังได้เครดิตเป็นผู้ประดิษฐ์ในสิทธิบัตร
เหตุผลหลักคือไอเดียการผลิตโซมาโทสแททินด้วยแบคทีเรียพันธุวิศวกรรมมาจาก Riggs และ Itakura ทั้งคู่เขียนรายละเอียดแผนการทดลองต่างๆ ไว้หมดตั้งแต่ตอนสมัครขอทุนจาก NIH ก่อนที่จะเริ่มงานนี้กับ Genentech และ UCSF ด้วยซ้ำ
ส่วน Boyer แม้จะขึ้นชื่อว่าเป็นเจ้าพ่อแห่งวงการพันธุวิศวกรรม แต่ก็มีเพียงบทบาทสนับสนุนด้านเทคนิคต่างๆ มากกว่าไอเดียหลัก
City of Hope ยังคงร่วมงานต่อกับ Genentech ไปอีกกว่าสองทศวรรษหลังจากนั้น ก่อนที่ทั้งสองฝั่งจะมีเรื่องขัดแย้งกันอีกเกี่ยวกับการแบ่งปันผลกำไรจากการขายอินซูลินและฮอร์โมนอื่นๆ ที่ City of Hope เคลมว่ามีส่วนร่วม
เคสฟ้องร้องนี้ยืดเยื้อมาจนถึงปี 2008 เมื่อศาลสูงแห่งแคลิฟอร์เนียตัดสินให้ Genentech จ่ายค่าเสียหายแก่ City of Hope ถึง 300 ล้านเหรียญสหรัฐ
งานวิจัยเรื่องการผลิตโซมาโทสแทนทินใน E.coil ถูกตีพิมพ์ในวารสารวิชาการชั้นนำอย่าง Science ในเดือนธันวาคม ปี 1997 กลายเป็นอีกหลักชัยสำคัญของ Genentech และวงการไบโอเทคของโลก
ก้าวต่อไปคือการสร้าง “อินซูลิน” โปรตีนฮอร์โมนที่ขนาดใหญ่กว่า ซับซ้อนกว่า แต่มูลค่าเศรษฐกิจมหาศาล
สะดวก ฉับไว คุ้มค่า สมัครสมาชิกนิตยสารมติชนสุดสัปดาห์ได้ที่นี่https://t.co/KYFMEpsHWj
— MatichonWeekly มติชนสุดสัปดาห์ (@matichonweekly) July 27, 2022